06:36 Алкогольная болезнь печени | |
Хроническое употребление алкоголя поражает все органы и системы. Но особое внимание стоит уделить алкогольным заболеваниям печени, которые включают в себя различные патологические состояния: от простого стеатоза до воспаления, цирроза и алкогольного гепатита [1]. Алкогольная болезнь печени является одним из наиболее распространенных заболеваний печени в Европе и США [3]. Заболевание может быть вызвано хроническим употреблением алкоголя, превышающим определенное суточное количество. Хроническое употребление > 40 г этилового спирта в день (что составляет 375 мл 13 % вина или > 1 литра 5 % пива) в течение длительного периода времени (годы) ассоциировано с высоким риском развития алкогольной болезни печени [4]. По результатам метаанализа, даже хроническое потребление 12–24 г алкоголя в день ассоциировано с повышенным риском развития цирроза печени (поздняя стадия алкогольной болезни печени), по сравнению с риском для людей, не употребляющих алкоголь [4]. Несомненно, вероятность развития цирроза печени зависит от продолжительности употребления алкоголя [1]. Алкогольная болезнь печени начинается с алкогольной жировой дистрофии, для которой характерен стеатоз печени — накопление триглицеридов в гепатоцитах. У некоторых людей прогрессирует воспаление печени, повреждение гепатоцитов и их увеличение, которое гистологически определяется как алкогольный стеатогепатит (АСГ) [2]. АСГ может развиваться медленно, с постоянным хроническим повреждением
печени и воспалением, в конечном итоге приводящим к прогрессирующему
фиброзу и циррозу. Впоследствии это может привести к развитию
гепатоцеллюлярной карциномы (ГЦК). В дополнение к этому, у людей с АБП
(с циррозом или без него) с быстро прогрессирующим АСГ может наблюдаться
алкогольный гепатит, который ассоциирован с плохим прогнозом для
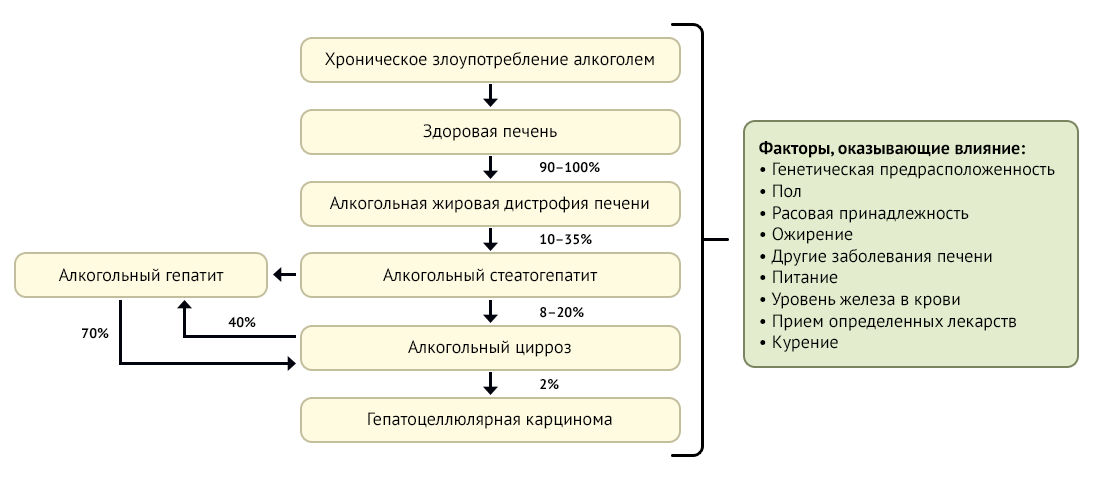
пациента [2]. Рисунок 1. Естественное течение алкогольной болезни печени Хроническое употребление алкоголя (>40 г этилового спирта в день) в течение длительного периода (месяцы или годы) приведет к развитию алкогольной жировой дистрофии печени у 90–100 % людей. У 10–35 % людей с алкогольной жировой дистрофией печени в случае продолжения употребления алкоголя развивается алкогольный стеатогепатит, который представляет собой воспаление печени, характеризующееся специфическими гистологическими особенностями. У 8–20 % хронических алкоголиков развивается алкогольный цирроз печени. Из этих 8–20 % пациентов с циррозом у ~2 % в год развивается гепатоцеллюлярный рак. У пациентов с тяжелым алкогольным стеатогепатитом может развиться острая клиническая форма алкогольного гепатита — заболевание, характеризующееся желтухой и печеночной недостаточностью. У 70 % пациентов, перенесших алкогольный гепатит, развивается цирроз печени. У 40 % пациентов с алкогольным циррозом печени также может развиться алкогольный гепатит, в этом случае смертность довольно высокая. Естественное течение алкогольной болезни печени изменяется различными факторами (вставка справа). Рисунок адаптирован из исходного варианта [16]. Факторы риска Существует взаимосвязь между количеством потребляемого алкоголя и риском развития АБП [5]. У большинства (90–100 %) хронических алкоголиков развивается алкогольная жировая дистрофия печени. У 10–20 % хронических алкоголиков развивается прогрессирующая АБП [2]. Среди факторов риска генетическая предрасположенность имеет наибольшее значение [6]. Женщины подвержены большему риску, чем мужчины. АБП у женщин развивается быстрее и при употреблении более низких доз алкоголя [7]. Наличие таких заболеваний печени, как вирусный гепатит B [9] или C [10], наследственный гемохроматоз [11], дефицит α1-антитрипсина [8] и неалкогольный стеатогепатит [12], ассоциировано с повышенным риском развития АБП. Люди с избыточным весом более склонны к токсическому воздействию алкоголя на печень [13]. Прием определенных лекарств или витаминов (парацетамола, изониазида, метотрексата, β-каротина) в сочетании с алкоголем способствует повреждению печени [14]. Курение увеличивает риск развития АБП в три раза [15]. Патофизиологические механизмы В развитие алкогольной жировой дистрофии печени вносят вклад метаболические изменения, эпигенетические изменения, окислительный стресс и воспаление. Перечисленные факторы воздействуют в первую очередь на гепатоциты и звездчатые клетки печени [2]. Генетика Среди генов, влияющих на чувствительность организма к хроническому употреблению алкоголя, гены модификаторов нейротрансмиссии (ГАМК) и модификаторов метаболизма алкоголя [17]. Отмечена роль полиморфизмов генов, которые [18]: Ацетальдегид и окислительный стресс Алкоголь в гепатоцитах окисляется алкогольдегидрогеназой до ацетальдегида, который затем метаболизируется до ацетата. Цитохром P450 2E1 (CYP2E1) — фермент, присутствующий в эндоплазматической сети и митохондриях гепатоцитов, метаболизирует алкоголь до ацетальдегида в присутствии кислорода и НАДФ. Такой метаболизм алкоголя является альтернативным, и этот путь запускается при хроническом злоупотреблении алкоголем (рис. 3) [2]. .
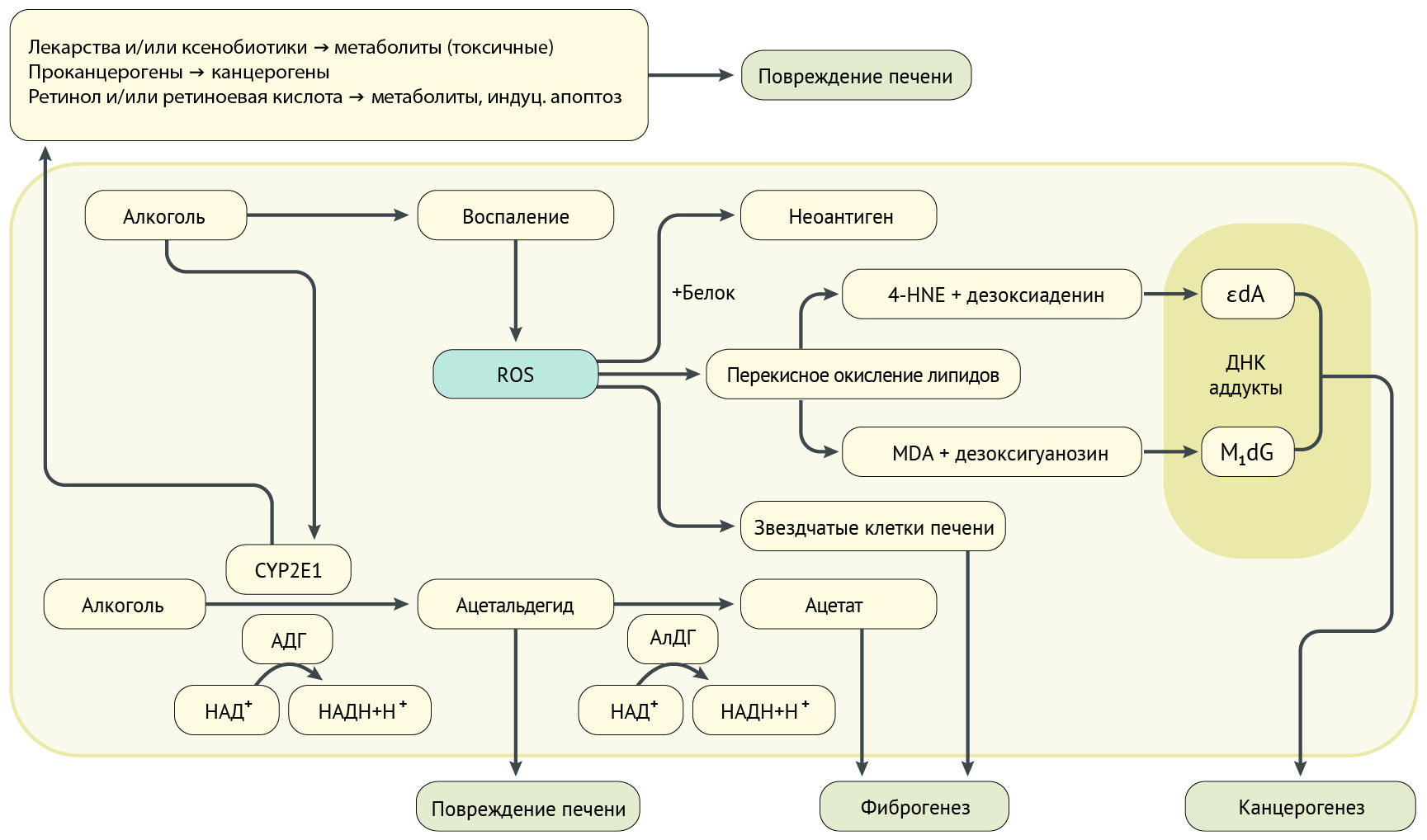
Рисунок 2. Метаболические пути, связанные с алкоголем В гепатоцитах алкоголь ферментируется до ацетальдегида при помощи фермента алкогольдегидрогеназы (АДГ), а ацетальдегид — до ацетата при помощи фермента ацетальдегиддегидрогеназы (АлДГ). Хроническое употребление алкоголя приводит к индукции цитохрома P450 2E1 (CYP2E1), который также метаболизирует алкоголь до ацетальдегида. Активные формы кислорода являются побочными продуктами этого метаболического пути. АФК также образуются в результате воспаления при алкогольном гепатите. CYP2E1 метаболизирует некоторые лекарственные средства (парацетамол или изониазид) до токсических метаболитов, активирует проканцерогены с образованием канцерогенов (например, нитрозаминов) и разлагает ретинол и ретиноевую кислоту до метаболитов, индуцирующих апоптоз. Все эти эффекты в дальнейшем способствуют повреждению печени. АФК могут связываться с белками и образовывать неоантигены, представляющие собой модифицированные белки организма, которые активируют иммунный ответ. АФК запускают перекисное окисление липидов. Продукты перекисного окисления липидов — 4-гидроксиноненал или малоновый диальдегид могут связываться с основаниями ДНК и образовывать канцерогенные экзоциклические этено-ДНК-аддукты. Ацетальдегид является токсичным и канцерогенным, связывается с белками, что приводит к структурным и функциональным изменениям митохондрий и микротрубочек и индуцирует образование неоантигенов [19]. Структурные изменения митохондрий приводят к снижению образования АТФ в дыхательной цепи, выработке активных форм кислорода (АФК) и окислительному стрессу, а также снижению активности ацетальдегиддегидрогеназы [16]. Эпигенетика Эпигенетические изменения включают ацетилирование и фосфорилирование, а также гипометилирование ДНК и изменения микроРНК [2]. Алкоголь модулирует ацетилирование гистона H3 посредством индукции активности гистонацетилтрансферазы и ингибирования гистондеацетилазы [20]. Происходит снижение экспрессии Sirtuin 1 в гепатоцитах, что приводит к усиленной регуляции стерол-регуляторного элемента, связывающего фактор транскрипции 1 (SREBP1), и последующему снижению метаболизма липидов в печени, что ведет к ожирению печени [21]. Связанная с алкоголем эпигенетическая регуляция также изменяет функции иммунных клеток. У макрофагов повышается активность гистондеацетилазы 11, регулятора IL-10, и это способствует снижению продукции противовоспалительного цитокина IL-10 [22]. Стеатоз печени Первым патофизиологическим ответом на хроническое употребление алкоголя является накопление жира (в основном триглицеридов, фосфолипидов и сложных эфиров холестерина) в гепатоцитах (стеатоз печени), что может привести к алкогольной жировой дистрофии печени. Потребление алкоголя может вызывать накопление жира в печени при помощи нескольких механизмов [2]: 1. Потребление алкоголя повышает отношение восстановленного НАД к окисленному НАД (НАДН/НАД+) в гепатоцитах, что препятствует β-окислению жирных кислот в митохондриях и приводит к стеатозу. Ингибирование убиквитин-протеасомного пути Убиквитин-протеасомный путь регулирует переваривание белка в клетке. С помощью данного механизма регулируются многие функции клеток печени, включая контрольные точки клеточного цикла и активацию факторов транскрипции (например, NF-κB и индуцируемый гипоксией фактор 1α — HIF1α). Потеря протеасом или ингибирование этого пути может привести к повреждению клеток, апоптозу и накоплению агрегированных цитокератинов в печени. Экспрессия генов в клетках печени зависит от активации транскрипционного фактора протеасомами. Активация определенных генов может ингибировать воспалительную реакцию печени и реакцию на гипоксическое повреждение [2]. Фиброз и цирроз Фиброгенез является предпосылкой развития цирроза печени. На более поздних стадиях АБП характеризуется развитием запущенного фиброза, что ассоциировано с ранней смертностью пациентов. Фиброз при AБП отличается накоплением перицеллюлярного и перисинусоидального матрикса. Постоянное употребление алкоголя усугубляет процесс [2]. Алкоголь, ацетальдегид и АФК (рис. 2) могут способствовать фиброгенезу печени, стимулируя иммунные клетки к образованию профиброгенных медиаторов. Алкоголь-опосредованное ингибирование нескольких антифиброзных путей также способствует фиброзу печени. Когда фиброз прогрессирует, печень становится цирротической и состоит преимущественно из соединительной ткани, что приводит к серьезному нарушению печеночного кровотока из-за сужения сосудов в печеночной дольке. В результате могут развиться осложнения: портальная гипертензия, асцит, варикозное расширение вен пищевода, печеночная недостаточность [2]. Источники: 1. Bajaj J. S. Alcohol, liver disease and the gut microbiota //Nature Reviews Gastroenterology & Hepatology. – 2019. – С. 1. 5. Lelbach W. K. Cirrhosis in the alcoholic and its relation to the
volume of alcohol abuse //Annals of the New York Academy of Sciences. –
1975. – Т. 252. – №. 1. – С. 85-105. Ссылка на оригинал: https://medach.pro/post/2133 | |
|
| |
| Всего комментариев: 0 | |