| Главная » Статьи » Медицина » Кардиология |
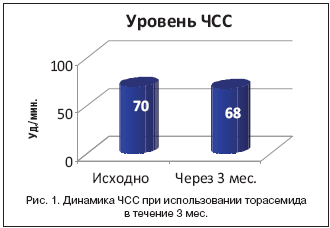
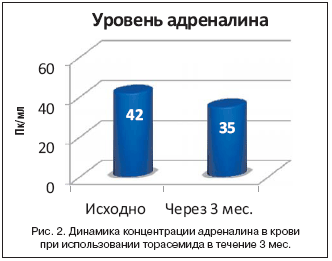
Значительно дольше других антигипертензивных препаратов используются тиазидные диуретики – с конца 50–х гг. прошлого века. Так, в 1956 г. был синтезирован первый пероральный тиазидный диуретик – хлортиазид. В 1957 г. был создан гидрохлоротиазид, который быстро вытеснил хлортиазид из клинической практики. В 1959 г. появился тиазидоподобный диуретик хлорталидон, a в 1974 г. – индапамид. В 1988 г. был создан торасемид. Как убедительно продемонстрировали результаты многоцентровых испытаний, этот препарат существенно отличается от предшественников по ключевым клинико–фармакологическим характеристикам эффективности и безопасности. Одним из важных отличий торасемида является его антиальдостероновый эффект, который был доказан в ряде исследований [8,9]. Синтез препарата с дополнительным свойством антагониста альдостерона был актуален, т.к. современная волна интереса к применению антагонистов альдостерона началась в конце 1990–х гг. у пациентов с хронической сердечной недостаточностью (ХСН) в связи со значительным улучшением прогноза таких больных (снижение смертности, частоты госпитализаций и выраженности симптоматики) в контролируемом клиническом исследовании RALES [10]. Учитывая, что альдостерон способствует развитию фиброза миокарда, истощению калия, активации симпатической и торможению парасимпатической нервной системы, а также дисфункции барорецепторов [11–13], антиальдостероновые свойства торасемида могут оказывать благоприятное воздействие на состояние больных с АГ. Традиционно одним из значимых недостатков использования тиазидных и петлевых диуретиков считалась избыточная активация ренин–ангиотензин–альдостероновой системы (РААС). Торасемид лишен данного недостатка. Так, в исследовании K. Harada и соавт. [14] было показано, что прием торасемида в дозе 8 мг/сут. на протяжении 3 мес. не вызывал значимого повышения уровня норадреналина, а уровень адреналина даже снижался с 42 до 35 пк/мл. При этом не наблюдалось изменения частоты сердечных сокращений (70 уд./мин. до исследования и 68 уд./ мин. – по окончании исследования) (рис. 1 и 2). Торасемид лишен важного недостатка, присущего некоторым диуретикам, – его применение не сопровождается развитием синдрома «рикошета». Так, прием фуросемида 1 р./сут. вызывает повышенную экскрецию натрия и воды во время диуреза, а затем сменяется задержкой натрия и воды в остальное время суток. В результате этого суточная экскреция натрия и воды может увеличиваться незначительно, если только короткодействующие диуретики не назначаются в высоких дозах или 2 р./сут. В основе данного феномена «рикошета» лежат несколько внутри– и внепочечных компенсаторно–приспособительных механизмов, направленных на поддержание водно–электролитного баланса в условиях недостаточного поступления натрия хлорида в организм, и в частности активация РААС. Торасемид в отличие от других диуретиков обладает дополнительным положительным эффектом в виде блокады РААС [15,16]. У пациентов с АГ в условиях стойкой гиперактивации РААС существенно возрастает активность альдостерона как фактора, обусловливающего задержку натрия и осмотически связанной воды. Помимо этого, избыточная продукция альдостерона всегда обусловливает значительное увеличение темпа ремоделирования органов–мишеней и связанное с этим нарастание риска сердечно–сосудистых осложнений. Уникальное свойство торасемида блокировать альдостероновые рецепторы [20] стало одним из определяющих в успешности его применения как при ХСН, так и при АГ. Для лечения ХСН торасемид в дозе от 5 до 20 мг/сут. является эффективным диуретиком. В субдиуретических дозах (2,5–5 мг/сут.) торасемид используется при лечении эссенциальной АГ как в качестве монотерапии, так и в комбинации с другими антигипертензивными препаратами. Так, в мультицентровом проспективном открытом исследовании A. Coca [17] приняли участие 5102 пациента с вновь выявленной АГ или не достигшие целевых значений АД на монотерапии недиуретическими препаратами. Через 6 мес. терапии торасемидом снижение систолического АД составило 22,1 мм рт.ст. (p<0,001), а диаcтолического АД – 14,1 мм рт.ст. (p<0,001). Для практических врачей особенно интересен факт снижения диастолического АД до уровня ниже 90 мм рт.ст. у 70–80% больных [18] при использовании торасемида в этих дозах. Снижение интенсивности ангиотензин II–AT I–сигнализации и стимуляция активности Na+/Са2+–насоса происходят посредством угнетения Na+–2Cl––K+–котранспортной системы, что снижает цитозольную активность Na+. В отличие от других петлевых диуретиков, которые тоже ингибируют Na+–2Cl––K+–котранспортную систему, торасемид по структуре сходен с блокатором Cl––каналов. Также торасемид имеет большее сродство, чем фуросемид, к Na+–2Cl––K+–котранспортной системе. Недавно было описано, что ангиотензин II стимулирует открытие Cl––каналов, что приводит к деполяризации мембраны. Этот процесс приводит к открытию Са2+–каналов, а значительно возрастающая концентрация Са2+–приводит к вазоспазму. Торасемид подавляет открытие Cl––каналов. Наличие дополнительного угнетения Cl––каналов у торасемида, по сравнению с фуросемидом, объясняет более мощный вазодилатационный эффект торасемида. Это объясняется тем, что вторая фаза входа Са2+ в клетку связана с открытием Cl– каналов. Блокирование обоих фаз входа Са2+ приводит в значимому противодействию вазоконстрикции [19,20]. Дополнительно описана способность торасемида повышать цГМФ в стенке сосуда и стимулировать повышение секреции простациклина в эндотелии сосудов, что приводит к дополнительной вазодилатации и обеспечивает устойчивый антигипертензивный эффект. В настоящее время имеются неоспоримый экспериментальный и клинический опыт, результаты крупных сравнительных исследований, ставящих торасемид в первые ряды выбора при фармакотерапии АГ и ХСН. Снижение интенсивности связывания альдостерона со специфическими рецепторами и уменьшение экскреции калия показаны [21] на гипертензивных крысах при применении торасемида, но не фуросемида; торасемид подавляет секрецию альдостерона в культуре клеток клубочкового слоя коры надпочечников различных млекопитающих [22]. В клинике достоверное увеличение концентрации альдостерона в сыворотке крови больных с ХСН регистрировалось под действием торасемида, но не фуросемида [23], что объяснено с позиций механизма отрицательной обратной связи, активирующегося в условиях блокады альдостероновых рецепторов торасемидом. В исследование Х.Х. Шугушева [24] были включены больные с ХСН III–IV функционального класса (NYHA), осложнявшей течение ИБС. В качестве диуретической терапии одна группа больных получала фуросемид в дозе 20–60 мг/сут., вторая группа – торасемид 5–20 мг/сут. Авторы полагают, что снижение частоты желудочковых нарушений ритма сердца в исследуемой группе торасемида связано с отсутствием неблагоприятного влияния на электролитный состав [15], a также со способностью снижать активность РААС. Известно также, что альдостерон потенцирует нежелательные последствия гиперактивации симпатической нервной системы, увеличивая захват катехоламинов клетками–мишенями, например кардиомиоцитами, и одновременно угнетая функцию парасимпатической нервной системы, ее участие в реализации барорефлекса [25]. Снижение показателей ВРС и смещение вегетативного баланса в сторону преобладания симпатических влияний при лечении фуросемидом, возрастание эктопической активности желудочков, по–видимому, связаны с его побочным эффектом, проявляющимся активацией РААС [16], в частности, повышением ренина плазмы, электролитными нарушениями. Для практического врача важно знать, что у торасемида отсутствует проаритмогенный эффект, свойственный индапамиду. Известно, что индапамид может удлинять интервал Q–T и предрасполагать к развитию желудочковой тахикардии типа «пируэт», что указывается в инструкции к этому препарату [26] и объясняется исследователями его способностью тормозить активность калиевых каналов в мембранах кардиомиоцитов. Функция мембранных калиевых каналов особенно нарушается у больных, страдающих сахарным диабетом и застойной сердечной недостаточностью [27], следовательно, для данной категории пациентов особенно опасно удлинение интервала Q–T под влиянием индапамида в плане развития желудочковых аритмий. Потенциально аритмогенное действие индапамида может проявляться при его совместном применении с препаратами из других клинико–фармакологических групп, которые также могут удлинять интервал Q–T. Поэтому при лечении индапамидом необходимо следить не только за содержанием калия в крови, но и за изменениями интервала Q–T, по крайней мере в начале лечения, что усложняет терапию и делает ее более дорогостоящей. Торасемид не инициирует рост плазменной концентрации самого агрессивного проаритмогенного медиатора – норадреналина, что выгодно отличает его от представителя того же подкласса диуретиков – азосемида [28]. Как известно, избыточный тонус симпатической нервной системы детерминирует не только АГ, но и прогрессирование ХСН. Устранением эффектов альдостерона во многом объясняется продемонстрированное в экспериментальных и клинических исследованиях торможение миокардиального фиброза при применении торасемида. Так, B. Lopez и соавт. [29] выполнили морфологическое исследование ткани миокарда межжелудочковой перегородки, полученной при биопсии у пациентов с ХСН II–IV функционального класса (NYHA). У пациентов, принимавших торасемид, было выявлено достоверное уменьшение экспрессии проколлагена I типа (PIP), маркера синтеза коллагена при сохранении скорости распада коллагена, характеризующегося постоянной концентрацией карбокситерминального телопептида проколлагена I типа (CITP). В последующем авторами было установлено, что прием торасемида сопровождается угнетением карбокситерминальной протеиназы проколлагена типа I – фермента, непосредственно участвующего в метаболическом каскаде, обусловливающем внеклеточное накопление коллагена I типа в миокарде, активируемое, в том числе, избытком альдостерона [30]. На одной из экспериментальных моделей ХСН P.T. Veeraveedu и соавт. [21] показали уменьшение площади индуцируемого избытком альдостерона миокардиального фиброза, экспрессии профиброгенного моноцитарного хемоаттрактантного протеина 1 типа (МСР–1), коллагена III типа и альдостеронсинтазы в миокарде левого желудочка под действием торасемида, но не фуросемида. Устранение тканевых эффектов альдостерона, очевидно, во многом позволяет объяснить положительное влияние торасемида на долгосрочный прогноз больных с ХСН и его способность уменьшать выраженность миокардиального ремоделирования. Положительное влияние на ремоделирование показано в работе Е.Е. Аверина [31]. При добавлении к комбинированной терапии больных препарата Диувер через 2 года лечения произошло не только достоверно большее снижение индекса массы миокарда левого желудочка, но и изменение типов ремоделирования, выражающееся улучшением геометрии левого желудочка. Торасемид уменьшает конечный диастолический и систолический диаметр левого желудочка [32] и индекс массы миокарда левого желудочка [31]. Способность торасемида предупреждать нарастание нарушений сократительной функции миокарда левого желудочка при ХСН подтверждало также уменьшение плазменной концентрации мозгового натрийуретического пептида [32]. Предупреждение последствий взаимодействия альдостерона с эпителиоцитами с рецепторами главных клеток собирательных трубочек предопределяет значительно меньшее, по сравнению с другими диуретиками, влияние торасемида на экскрецию калия с мочой. В исследовании TORIC [33] частота гипокалиемии, отмеченная при применении торасемида, оказалась достоверно ниже, чем при использовании фуросемида. В низких дозах торасемид оказывает длительное антигипертензивное действие, незначительно влияя на содержание калия в крови и показатели пуринового, углеводного и липидного метаболизма. Благодаря этому он в отличие от петлевых диуретиков первого поколения может более безопасно использоваться для длительного лечения АГ [14,17,34]. Все новые руководства отмечают необходимость назначения комбинированной терапии большинству пациентов с АГ. У практического врача не должно быть колебаний при назначении диуретиков больным с АГ – этот класс препаратов необходим большинству из них, а особенно «проблемным» пациентам: в сочетании с ХСН, при резистентной гипертензии [34–36]. Однако «классические» тиазидные диуретики в ряде ситуаций могут создать ненужные сложности как для врача, так и для пациента. И в этой ситуации необходимо понять, что существующие ограничения (метаболические проблемы и снижение уровня калия при применении тиазидных диуретиков) пододвигают нас к решению проблемы, а не просто лимитируют назначение диуретиков при АГ. Одним из таких решений может служить использование торасемида. В России наиболее популярным торасемидом является Диувер (по данным Pharmexpert, 2012). Недавно появился торасемид пролонгированной формы. Гипотетически такие формы высвобождения могут обеспечивать дополнительные преимущества в сравнении с формами быстрого высвобождения. В связи с этим представляется интересным сравнить подробно препараты двух форм высвобождения – обычной (немедленного высвобождения) и пролонгированного высвобождения. У обоих препаратов с различной формой высвобождения концентрации активного вещества в крови уже через 6 ч становятся одинаковыми. Объем мочи, количество натрия, хлора и калия, выделенные за сутки, не различались у пациентов, принимавших торасемиды различных форм высвобождения [37,38]. В литературе встречаются данные, что в первый час после принятия препарата объем выделенной мочи на препарате с немедленным высвобождением больше, чем на препарате с пролонгированным высвобождением. Так, в работе M.J. Barbanoj и соавт. [37] разница в объеме мочи в первый час после приема препаратов составила 123,3 мл (578,27 против 455 мл). Учитывая, что импульсы в мозг от мочевого пузыря формируются при его наполнении более 150 мл, логично предположить, что этот объем не будет оказывать значимого влияния на количество позывов к мочеиспусканию. Это предположение нашло свое подтверждение в проведенном сравнительном исследовании M.J. Barbanoj и соавт. [37]. Так, при применении торасемида в течение 4 дней количество неотложных позывов к мочеиспусканию у разных форм высвобождения было сопоставимо. После приема пролонгированной формы отмечались 1–2 эпизода неотложного позыва к мочеиспусканию в среднем через 1,37 и 3,03 ч, а после применения обычного торасемида – 1–2 эпизода через 1,12 и 3,03 ч. При этом средние субъективные оценки интенсивности позывов, оцененные по визуально–аналоговой шкале, были 81,25 и 74,06 у пролонгированной формы и 83,87 и 77,2 у обычной формы высвобождения. Как следует из вышесказанного, ни интенсивность позывов к мочеиспусканию, ни частота мочеиспусканий не отличались у торасемидов различных форм высвобождения. Интересная находка была сделана в исследовании S. Gropper и соавт. [39]: при назначении торасемида пролонгированного высвобождения в дозе 5 мг было больше острых мочеиспусканий, чем при принятии обычного торасемида 5 мг. Т.к. доза 5 мг рекомендована для лечения АГ, то для пациентов с АГ меньшее количество острых позывов будет субъективно переноситься лучше, т.е. применение обычного торасемида при АГ является предпочтительным. При приеме 10 мг торасемида немедленного высвобождения количество мочеиспусканий было больше по сравнению с 10 мг пролонгированного высвобождения. Учитывая, что доза 10 мг чаще используется в лечении отеков у пациентов с ХСН, то управляемый и прогнозированный диурез является положительным моментом, обусловливающим целесообразность применения обычной формы торасемида. Между обычной формой торасемида и пролонгированного высвобождения не исключена разница в отношении их влияния на фиброз миокарда. Эта клиническая выгода, связанная с длительным применением препаратов, подтверждена для формы быстрого освобождения в исследовании B. Lоpez [29], а у пролонгированной формы этот процесс не доказан (исследование TORAFIC). Так, исходя из содержания карбокситерминального пропептида коллагена I типа в сыворотке крови, в исследовании TORAFIC долгосрочное лечение лекарственной формой торасемида с контролируемым высвобождением или фуросемидом больных с АГ, страдавших легкой клинически стабильной ХСН, не оказало достоверного влияния на развитие фиброза миокарда [37]. В проспективное наблюдательное сравнительное исследование TORIC были включены 1377 пациентов из 231 клиники Испании, страдавших ХСН II–III функциональных классов (NYНА), которые были разделены на прием торасемида или фуросемида, а также других диуретиков. Наблюдали за пациентами 12 мес. Средняя доза принимаемого торасемида обычной формы высвобождения составила 8,2±2,4 мг/сут., а фуросемида – 35,0±7,2 мг/сут. У пациентов, принимавших торасемид обычной формы высвобождения, общая смертность была ниже на 51,5% (p<0,05), сердечно–сосудистая смертность – на 59,7% (p<0,05), внезапная смертность – на 65,8%, чем у пациентов, принимавших фуросемид. За год наблюдения уровень калия изменился с 4,28 до 4,22 ммоль/л, т.е. на 0,06 ммоль/л за 12 мес. ежедневного приема в средней дозе 8,2 мг/сут. Интересно отметить, что сопоставление инструкций к применению Диувера и бритомара на сайте Минздравсоцразвития РФ (Государственный реестр лекарственных средств) [26] по разделу «Показания» свидетельствует о полном их совпадении, по разделу «Противопоказания» в инструкции полного совпадения нет, в частности, в противопоказаниях к бритомару имеется указание на синусовую брадикардию и АВ–блокаду II–III степени, чего нет у Диувера. С точки зрения сравнительного фармакоэкономического аспекта в доступной нам литературе данных об этих препаратах не обнаружено. Начальное сравнение прямой стоимости показывает преимущество Диувера на 18%. Так, наиболее часто используемая дозировка при лечении АГ Диувером – 5 мг № 60 стоит 536 руб., т.е. на 1 мес. терапии –268 руб. Бритомар 5 мг № 30 стоит 317 руб. (на 1 мес.) (стоимость указана на 25.09.2012 г. с сайта http://www.aptekaonline.ru). С учетом уникальности клинических эффектов торасемида и его высокой безопасности, а также расширения показаний по рекомендациям ведения АГ и ХСН экспертами ведущих отечественных и зарубежных профессиональных сообществ, с нашей точки зрения, актуально проведение полноценного проспективного длительного фармакоэкономического сравнительного исследования торасемида различных производителей. Заключение. Торасемид – это лекарственное средство с антиальдостероновым и антигипертензивным свойствами, обладающее дозозависимым диуретическим эффектом. В дозировках 2,5–5 мг оказывает преимущественно антигипертензивное и антиальдостероное действие со слабым натрийуретическим эффектом, что позволяет использовать торасемид для ежедневной постоянной терапии АГ. В целом, в многочисленных исследованиях на сегодняшний день доказано, что торасемид является первым представителем нового поколения петлевых диуретиков, которые по спектру фармакологических эффектов принципиально отличаются от петлевых диуретиков первого поколения. Антиальдостероновые эффекты, в основе которых лежит способность торасемида блокировать альдостероновые рецепторы в почках и сердце и тормозить секрецию альдостерона надпочечниками, обеспечивают позитивные эффекты для лечения ХСН, отеков различного генеза. Торасемид не активирует симпатическую нервную систему (не влияет на уровень адреналина и норадреналина) и не увеличивает ЧСС. Торасемид тормозит синтез нового коллагена при сохранении скорости его распада, что выражается в снижении общей фракции коллагена в тканях, например в сердце. Клинические данные свидетельствуют об уменьшении гипертрофии левого желудочка. Торасемид обычной формы высвобождения (немедленной) сопоставим по суточному объему выделенной мочи с пролонгированным торасемидом. При ежедневном приеме торасемидов разных форм высвобождения как количество неотложных позывов к мочеиспусканию, так и сила позывов, оцененная по визуально–аналоговой шкале, были сопоставимы. Однако у торасемида немедленной формы высвобождения доказано действие, уменьшающее фиброз миокарда, и положительное влияние на смертность пациентов, в отличие от пролонгированной формы, у которой отсутствуют доказательства влияния на эти параметры.
Источник: http://www.rmj.ru/articles_8432.htm | |
| Просмотров: 3687 | Теги: | Рейтинг: 0.0/0 |
| Всего комментариев: 0 | |