| Главная » Статьи » Медицина » Гастроэнтерология |
Современные бактериологические препараты: влияние на микробиоту кишечника и роль в лечении заболеваний
ПробиотикиСогласно современному определению, сформулированному в 2002 г. экспертами ВОП (Всемирной организации по продовольствию ООН) и ВОЗ (Всемирной организации здравоохранения), пробиотики являются «живыми штаммами строго отобранных микроорганизмов, которые при назначении в достаточных количествах оказывают благоприятное действие на здоровье хозяина». Это определение в 2013 г. было поддержано Международной научной ассоциацией пробиотиков и пребиотиков (ISAPP) [1].Согласно предложениям ВОЗ, ВОП и ЕАБП (Европейского агентства по безопасности продовольствия (EFSA)), пробиотические штаммы должны отвечать таким критериям, как безопасность, устойчивость и практичность (табл. 1) [2, 3]. 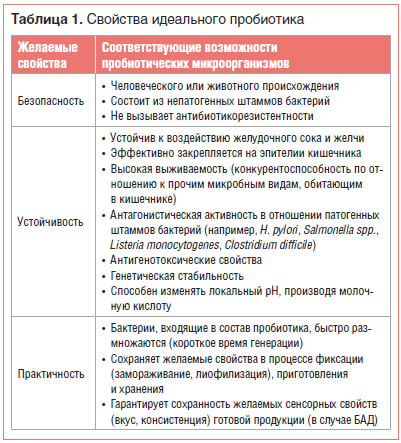 Безопасность для здоровья — первичная и обязательная характеристика пробиотика. В США микроорганизмы, используемые в пищу, обязательно должны иметь статус GRAS (Generally Regarded As Safe — обычно считающийся безопасным), выдаваемый Управлением по контролю за продуктами и лекарствами (FDA). В Европе EFSA ввело термин QPS (Qualified Presumption of Safety — квалифицированная презумпция безопасности). Концепция QPS включает некоторые дополнительные критерии оценки безопасности бактериальных добавок, в т. ч. историю безопасного использования и отсутствие риска приобретенной резистентности к антибиотикам [4]. В частности, по мнению экспертов EFSA, в соответствии с QPS безопасными являются 5 видов бифидобактерий (Bifidobacterium spp.), 33 вида лактобактерий (Lactobacillus spp.), а также Lactoccocus lactis, Leuconostoc spp., Pediococcus spp., Propionibacterium freudenreichii и Streptococcus thermophilus [4]. Пробиотики могут содержать либо один штамм, либо смесь двух или более штаммов бактерий. Эффекты этих препаратов очень специфичны и зависят от сопутствующей терапии, состава микробиоты хозяина и заболевания, по поводу которого принимают пробиотик. В небольшом ряде исследований была показана бóльшая эффективность приема пробиотиков, в состав которых входит не один, а несколько штаммов бактерий [3, 5]. В таблице 2 представлены пробиотические микроорганизмы, наиболее часто содержащиеся в современных фармацевтических препаратах и пищевых добавках [6].  Пробиотики могут обладать множеством полезных эффектов в отношении организма человека. Молекулярные и генетические исследования показали, что в основе этих эффектов лежат 4 главных механизма: – производство антимикробных веществ [7]; – конкуренция с патогенами за адгезию к эпителию и за питательные вещества [8]; – иммуномодулирующее воздействие на организм хозяина [9]; – ингибирование выработки бактериальных токсинов [10]. Иммуномодулирующее действие пробиотических бактерий основано на 3-х, казалось бы, противоречивых эффектах [9, 11]: – активации и поддержании состояния иммунологической толерантности к пищевым и ингаляционным антигенам; – активации и контроле иммунологических реакций против патогенов бактериального и вирусного происхождения; – ингибировании аутоагрессивных и аллергических реакций. Вызываемая пробиотиками стимуляция иммунитета проявляется в увеличении производства иммуноглобулинов, усилении активности макрофагов и лимфоцитов и стимуляции продукции γ-интерферона. Пробиотики могут влиять на иммунную систему человека посредством производимых цитокинов, компонентов клеточной стенки и ДНК, распознаваемых специализированными клетками хозяина [12]. К настоящему времени накоплена значительная научная база, подтверждающая, что модификация микробиоты с помощью препаратов и продуктов, содержащих пробиотики (Lactobacillus salivarius, Lactobacillus acidophilus, Lactobacillus rhamnosus, Saccharomyces boulardii, ряд видов Bifidobacterium и др.), может смягчать течение и способствовать лечению целого ряда состояний: ожирения, дислипидемии, инсулинорезистентности, сахарного диабета 2 типа (СД 2), неалкогольной жировой болезни печени (НАЖБП), синдрома раздраженной кишки, диареи различного генеза, воспалительных заболеваний кишечника, атопического дерматита, лактозной непереносимости, колоректального рака [13–23]. Доказано благотворное влияние пробиотиков как на взрослых, так и на детей. Так, в исследовании, проведенном M. Kotowska et al. (Польша), было установлено, что S. boulardii эффективно снижает риск антибиотик-ассоциированной диареи у детей. В этом двойном слепом рандомизированном плацебо-контролируемом исследовании приняли участие в общей сложности 269 детей в возрасте от 6 мес. до 14 лет, с отитом и/или инфекциями дыхательных путей. Дети получали стандартное лечение антибиотиками, в добавление к которому экспериментальная группа (n=132) 2 р./сут получала по 250 мг S. boulardii per os, а контрольная группа (n=137) — плацебо. Выяснилось, что пациенты, получавшие S. boulardii, имели более низкую распространенность диареи (9 человек из 119 (8%) против 29 из 127 (23%), ОР 0,3; 95% ДИ 0,2–0,7) и более низкий риск ассоциированной с антибиотиками диареи (вызванной Clostridium difficile) или иной иначе необъяснимой диареи по сравнению с группой плацебо (4 из 119 (3,4%) против 22 из 127 (17,3%), ОР 0,2; 95% ДИ 0,07–0,5). Никаких побочных эффектов не наблюдалось [16]. Исследование, проведенное на базе 18 детских садов в Хельсинки (Финляндия), показало, что регулярное использование Lactobacillus rhamnosus GG в форме пробиотика приводило к уменьшению числа инфекций дыхательных путей. Чтобы выяснить, может ли долгосрочное потребление молока, обогащенного пробиотиками, уменьшить частоту желудочно-кишечных и респираторных инфекций у детей в детских садах, финские ученые провели 7-месячное рандомизированное двойное слепое плацебо-контролируемое исследование, в которое включили 571 здорового ребенка в возрасте от 1 до 6 лет. Дети получали молоко с или без Lactobacillus GG в среднем по 260 мл в день. В итоге у детей в группе Lactobacillus было меньше пропусков из-за болезни (4,9 против 5,8 дня, разница 16%, p=0,03). Кроме того, в группе Lactobacillus оказалось на 17% меньше детей, переболевших за время наблюдения респираторными инфекциями, и на 19% меньше детей нуждались в антибиотикотерапии при респираторной инфекции [24]. В июне 2017 г. в журнале Nutrients группой итальянских ученых, возглавляемых G. Corsello, были опубликованы результаты многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования, охватившего 126 здоровых детей в возрасте 12–48 мес., которые ежедневно получали по 7 г обезжиренного молока коровы с добавлением L. paracasei CBA L74 (группа A) или плацебо (мальтодекстрины, группа B). При анализе результатов выяснилось, что доля детей, перенесших более 1 эпизода простудных заболеваний, в группе А составляла 18%, тогда как в группе B этот показатель достиг 40%. Доля детей, более 1 раза перенесших инфекцию дыхательных путей, также оказалась значительно ниже в группе A (51% против 74% в группе В, p<0,05). Острый гастроэнтерит более 1 раза за период наблюдения перенесли только 18% детей в группе А и 40% — в группе В. Значительные изменения биомаркеров врожденного и приобретенного иммунитета наблюдались только у детей в группе A. Исследователи заключили, что добавки с обезжиренным коровьим молоком, ферментированные L. paracasei CBA L74, могут эффективно предотвращать инфекционные заболевания различного рода у детей [25]. ПребиотикиПребиотики в основном представляют собой неперевариваемые в кишечнике пищевые волокна, которые благотворно влияют на здоровье хозяина, избирательно стимулируя рост и активность некоторых видов микроорганизмов в толстой кишке — как правило, лактобактерий и бифидобактерий [26].Существует короткий список основных критериев, которым должен соответствовать пребиотик (табл. 3) [27, 28]. 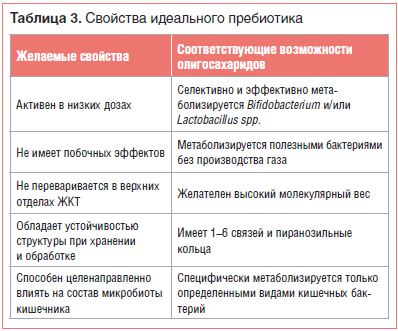 Пребиотики способны стимулировать рост нативных кишечных бактерий, обладают огромным потенциалом для модификации микробиоты кишечника, однако все изменения происходят на уровне отдельных штаммов и видов кишечных бактерий и являются труднопредсказуемыми. Кроме того, кишечная среда, особенно pH, играет ключевую роль в определении результатов межвидовой конкуренции. Таким образом, результаты приема этих препаратов могут быть крайне индивидуальны [29]. Некоторые фрукты, овощи, зерновые культуры и другие съедобные растения могут служить естественными источниками пребиотиков. Среди них: томаты, артишоки, бананы, спаржа, ягоды, чеснок, лук, цикорий, зеленые овощи, бобовые, а также необработанный овес, нерафинированная пшеница, неочищенный ячмень, якон [30]. Пребиотики могут использоваться в качестве альтернативы или дополнения к пробиотикам. Стабильность структуры в течение длительного времени, устойчивые физические и химические свойства, которые оказывают положительное влияние на вкус и консистенцию продуктов, в которых они содержатся, позволяют пребиотикам составить достойную конкуренцию пробиотикам. Пребиотики могут потребляться длительно и в профилактических целях. Они не являются аллергогенными и не способствуют развитию устойчивости к антибиотикам. Однако следует учитывать, что передозировка пребиотиков может привести к метеоризму и диарее — эти эффекты отсутствуют в случае чрезмерного потребления пробиотиков [31]. Пищевые волокна являются потенциальными пребиотиками. Они вызывают чувство насыщения, но не перевариваются в ЖКТ. Существенное различие между этими двумя терминами (пребиотики и пищевые волокна) заключается в том, что пребиотики ферментируются строго определенными группами микроорганизмов, а диетические волокна используются большинством кишечных бактерий. Поэтому, принимая во внимание одно из основных требований к пребиотикам (специфическая стимуляция микробиоты), следует отметить, что эти термины не являются взаимозаменяемыми. Пребиотик может быть диетическим волокном, но диетическое волокно не всегда является пребиотиком [32]. Наиболее перспективными пребиотиками, о чем свидетельствуют исследования in vitro и in vivo, являются олигосахариды, в т. ч.: фруктоолигосахариды (FOS), галактоолигосахариды (GOS), изомальтоолигосахариды (ИМО), ксилоолигосахариды (XOS), трансгалактоолигосахариды (TOS) и олигосахариды сои (SBOS) [33]. Кроме того, полисахариды, такие как инулин, крахмал, целлюлоза, гемицеллюлоза или пектин, потенциально могут быть пребиотиками. Примеры пребиотиков, которые наиболее часто используются в питании человека, представлены в таблице 4. Использование глюкоолигосахаридов, гликоолигосахаридов, лактита, изомальтоолигосахаридов, стахиозы, рафинозы и сахарозы в качестве пребиотиков требует дальнейших исследований [34]. 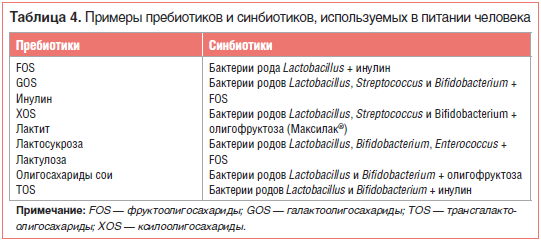 Насколько удалось установить на сегодняшний день, несмотря на разнообразие углеводов, которые проявляют пребиотическую активность, эффект приема любого из них заключается в увеличении количества полезных бактерий, в основном из рода Bifidobacterium [35]. Механизм положительного влияния пребиотиков на иммунитет остается неясным. Предложено несколько возможных моделей [36]: Пребиотики регулируют действие печеночных липогенных ферментов, влияя на увеличение производства короткоцепочечных жирных кислот (КЦЖК), таких как пропионовая кислота. Получаемые в результате ферментации КЦЖК (особенно масляная кислота) — модуляторы ацетилирования гистонов, что увеличивает доступность многочисленных генов для факторов транскрипции. Регуляция производства муцина. FOS и несколько других пребиотиков вызывают увеличение количества лимфоцитов и/или лейкоцитов в кишечно-связанных лимфоидных тканях (GALT) и в периферической крови. Повышенная секреция IgA GALT может приводить к активации макрофагов. Существует очень мало задокументированных результатов исследований, свидетельствующих о возможности прямого ингибирования развития патогенов пребиотиками. В 1997 и 2003 гг. Bovee-Oudenhoven et al. изучали использование лактулозы в профилактике инфекций, вызываемых Salmonella enteritidis, на модели крысы. Их результаты показали, что подкисление кишечника, возникающее в результате ферментации лактулозы, тормозило развитие патогенов и способствовало выведению патогенов из кишечника. Было также продемонстрировано, что прием пребиотиков приводит к усилению всасывания минералов, главным образом магния и кальция, в кишечнике [37, 38]. Спектр заболеваний, на течении которых благотворно сказывается прием пребиотиков, широк и во многом пересекается со сферой влияния пробиотиков [39–46]. Например, было доказано, что прием пребиотиков является эффективной профилактикой развития инфекционных заболеваний и аллергии у детей. В ходе исследования, проведенного группой итальянских ученых, здоровых новорожденных с родительской историей аллергии кормили смесью с добавлением пребиотика (8 г/л GOS/FOS) либо плацебо в течение первых 6 мес. жизни. Ученые отметили, что за период исследования у младенцев в группе пребиотика было меньше эпизодов инфекционных заболеваний всех типов (p=0,01), меньше эпизодов инфекции верхних дыхательных путей (р=0,07) и меньше инфекций, требующих лечения антибиотиками (р=0,10). Также в группе пребиотика значительно реже возникали рецидивирующие инфекции (3,9% в группе GOS/FOS против 13,5% в группе плацебо, p<0,05). Ученые предположили, что основным механизмом наблюдаемого феномена стал иммуномодулирующий эффект пребиотической смеси, связанный с модификацией кишечной флоры [45]. СинбиотикиСинбиотик представляет собой комбинацию пробиотика и пребиотика. Он благотворно влияет на организм хозяина за счет улучшения выживаемости и имплантации бактерий пробиотика в ЖКТ путем избирательной стимуляции роста этих бактерий пребиотиком [3]. Таким образом, свойства синбиотика и его влияние на здоровье связаны с индивидуальной комбинацией пробиотика и пребиотика [2, 3]. В настоящее время наиболее популярна комбинация бактерий рода Bifidobacterium или Lactobacillus с фруктоолигосахаридами (табл. 4). С учетом огромного количества возможных комбинаций применение синбиотиков для модуляции кишечной микробиоты представляется многообещающим.Идеальный синбиотик должен обладать следующими свойствами: безопасность компонентов для хозяина; доказанная польза компонентов синбиотика для хозяина; избирательная стимуляция роста компонентов пробиотика на субстрате пребиотика; повышенная выживаемость пробиотика при прохождении через гастроинтестинальный тракт; устойчивость структуры при хранении. В литературе есть указания на то, что из-за использования пребиотиков пробиотические микроорганизмы приобретают более высокую толерантность к условиям окружающей среды, в т. ч. устойчивость к окислению, воздействию низкого рН и температуры. Стимуляция пробиотиков пребиотиками способствует регуляции метаболической активности в кишечнике, развитию полезной микробиоты и ингибированию потенциальных патогенов, присутствующих в ЖКТ. Употребление синбиотиков приводит к снижению концентрации нежелательных метаболитов, инактивации нитрозаминов и канцерогенных веществ, а также значительному увеличению уровней КЦЖК, кетонов, дисульфидов углерода и метилацетатов, что может благоприятно отражаться на здоровье хозяина. Однако механизм взаимно поддерживающего действия компонентов синбиотика пока недостаточно изучен [26]. Главные эффекты, которыми обладают синбиотики [47]: увеличение количества Lactobacillus и Bifido-bacterium и поддержание баланса кишечной микробиоты; улучшение функции печени у пациентов, страдающих циррозом; иммуномодулирующее воздействие; профилактика бактериальной транслокации и снижение частоты нозокомиальных инфекций в послеоперационном периоде. Транслокация продуктов метаболизма бактерий, таких как липополисахариды, этанол и КЦЖК, приводит к их проникновению в печень. КЦЖК, к примеру, стимулируют синтез и хранение триглицеридов в печени, что постепенно приводит к стеатогепатозу. Рандомизированное исследование по использованию синбиотика, содержащего 5 пробиотиков (Lactobacillus plantarum, Lactobacillus delbrueckii spp. Bulgaricus, Lactobacillus acidophilus, Lactobacillus rhamnosus, Bifidobacterium bifidum) и инулин в качестве пребиотика, у взрослых пациентов с НАЖБП продемонстрировало значительное сокращение запасов триглицеридов в печени в течение 6 мес. [48]. В 2013 г. Danq et al. опубликовали метаанализ исследований эффективности про- и пребиотиков для профилактики экземы у детей. Этот метаанализ показал, что пробиотики или синбиотики могут достоверно снизить частоту возникновения экземы у детей в возрасте младше 2 лет [49]. Примером соответствия всем современным требованиям, предъявляемым к синбиотику, является Максилак®. В его составе — сочетание лиофильно высу- шенных штаммов пробиотических бактерий: 3 штаммов бифидобактерий (B. longum 6,75×108 КОЕ, B. breve 4,5×108 КОЕ, B. bifidum 2,25×108 КОЕ), 4 лактобактерий (L. helveticus 9×108 КОЕ, L. rhamnosus 4,5×108 КОЕ, L. plantarum 2,25×108 КОЕ, L. casei 2,25×108 КОЕ) и 2 штам-мов молочнокислых микроорганизмов (Lactococcus lactis 9×108 КОЕ, Streptococcus thermophilus 4,5×108 КОЕ). Пребиотическим компонентом в этом препарате выступает олигофруктоза, которая способствует быст- рому размножению бифидобактерий и увеличению устойчивости микробиоты кишечника к инфекциям [50]. Особая форма препарата в виде саше с микрогранулами, разработанная специально для детей старше 4 мес., помогает преодолеть последствия нарушения микрофлоры, которое может возникнуть из-за кесарева сечения при родах, употребления молочных смесей и приема некоторых лекарственных препаратов. В состав синбиотика Максилак® Бэби входят те же 9 штаммов пробиотических бактерий, эффективность которых подтверждена в описанных выше исследованиях, в оптимальной для кишечника ребенка концентрации — 1 млрд (1×109) КОЕ. Одно из ключевых свойств синбиотика — устойчивость к неблагоприятным условиям окружающей среды зависит от надежности капсулы препарата. Технология защиты капсулы MURE® (Multi Resistant Encapsulation) позволяет защитить бактерии, присутствующие в синбиотике Максилак®, от кислого содержимого желудочного сока, солей желчи и пищеварительных ферментов, а также делает возможным хранение препарата при комнатной температуре [51]. Сбалансированный состав, доказанная польза и безопасность компонентов препарата (наличие сертификата GRAS), устойчивая структура и удобная кратность приема (1 р./сут), а также отсутствие в составе лактозы и казеина (что обеспечивает возможность применения у пациентов с лактазной недостаточностью) выделяют Максилак® на фоне прочих средств, которые применяются в рамках коррекции патологических изменений микрофлоры кишечника, возникающих при заболеваниях ЖКТ и применении ряда лекарств (антибиотиков, гормональных и нестероидных противовоспалительных препаратов, противогрибковых средств) не только у взрослых, но и у детей. ЗаключениеМногочисленные научные работы подтверждают положительное влияние пробиотиков на микробиоту кишечника и здоровье хозяина в целом. Пробиотические микроорганизмы обладают высоким терапевтическим потенциалом, например, при ожирении, инсулинорезистентности, СД 2, НАЖБП, лактозной непереносимости и атопическом дерматите. Также пробиотики могут быть полезны при лечении синдрома раздраженной кишки, энтерита, бактериальных инфекций и различных желудочно-кишечных расстройств. Пребиотики могут использоваться в качестве альтернативы пробиотикам или в качестве дополнительной поддержки для них. Наиболее перспективным представляется использование биотерапевтических формул, содержащих как пробиотические микробные штаммы, так и синергические пребиотики. Такие комбинации могут быть более эффективны, чем употребление их отдельно взятых компонентов [52]. Ожидается, что будущие исследования смогут объяснить механизмы комплементарного взаимодействия про- и пребиотиков в составе синбиотиков.Источник: https://www.rmj.ru/articles/pediatriya/Sovremennye_bakteriologicheskie_preparaty_vliyanie_namikrobiotu_kishechnika_iroly | |
| Просмотров: 881 | Теги: | Рейтинг: 0.0/0 |
| Всего комментариев: 0 | |
